Συνοπτικές Περιγραφές Πειραμάτων Χημείας
Συνοπτικές Περιγραφές Πειραμάτων ΧημείαςΓυμνάσιο - A' ΛυκείουΗλεκτρόλυση νερούΗλεκτρόλυση νερού με ηλεκτρολύτη
Γυμνάσιο - A' Λυκείου
Ηλεκτρόλυση νερού
Ηλεκτρόλυση νερού με ηλεκτρολύτη
Οι αντιδράσεις που λαμβάνουν χώρα είναι:
Ομως, τα ιόντα
Ο όγκος του
Ηλεκτρόλυση νερού με ηλεκτρολύτη
Οι αντιδράσεις που λαμβάνουν χώρα είναι:
οι οποίες μας δίνουν το συνολικό μηχανισμό της ηλεκτρόλυσης
Αρχή του Lavoisier
Αρχή διατήρησης της μάζας του Lavoisier
Προσθήκη διαλύματος
Προσθήκη διαλύματος
Τοποθέτηση του σωλήνα μέσα στην κωνική φιάλη.
Ζύγιση της φιάλης μαζί με το σωλήνα πριν και μετά την αντίδραση.
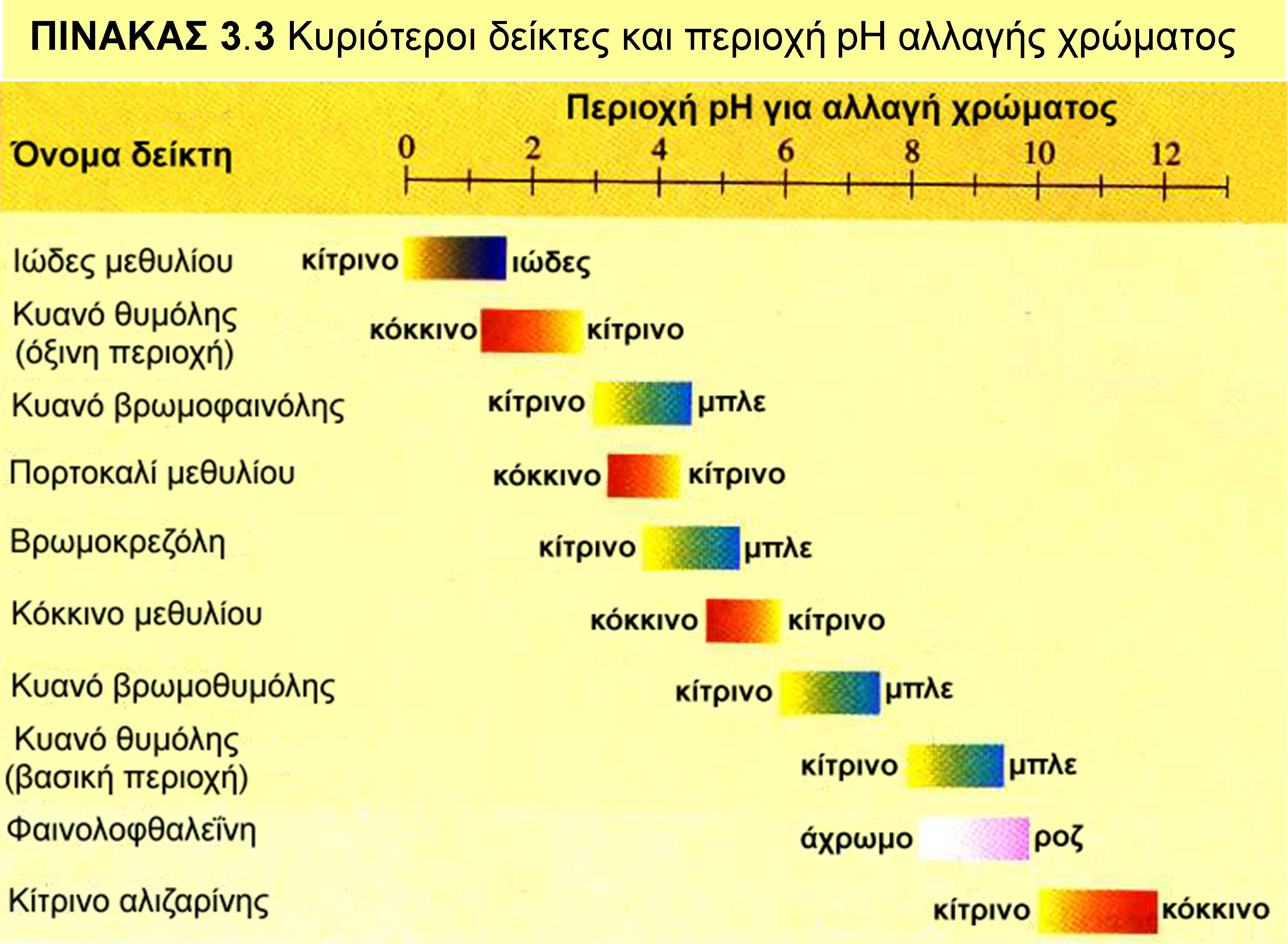
Οξέα-Βασεις
Αλλαγή δεικτών
ΔΕΙΚΤΕΣ ΟΞΕΩΝ
- O δείκτης που ονομάζεται βάμμα ηλιοτροπίου έχει μενεξεδί (ή όπως αλλιώς λέγεται ιώδες χρώμα). Όταν όμως πέσει σε διάλυμα οξέος, αλλάζει χρώμα και γίνεται κόκκινος.
- Όμοια ο δείκτης ηλιανθίνη που είναι κίτρινος, θα χρωματίσει το όξινο διάλυμα κόκκινο διότι παρουσία οξέος ο δείκτης ηλιανθίνη είναι κόκκινος.
ΔΕΙΚΤΕΣ ΒΑΣΕΩΝ
- Πιο συγκεκριμένα, το μπλε της βρωμοθυμόλης σε βασικό διάλυμα, από μενεξεδί (ιώδες) γίνεται μπλε.
- Η φαινολοφθαλεΐνη από άχρωμη γίνεται κόκκινη
Αντίδραση οξέος - βάση προς παράγωγη αλάτων
Αντιδράσεις Αντικατάστασης
Απλή αντικατάσταση
Στην κατηγορία αυτή ένα στοιχείο ( μέταλλο ή αμέταλλο) αντικαθιστά ένα άλλο στοιχείο σε μια χημική ένωση (απλή αντικατάσταση).
Α. Μέταλλα
Α1. Επίδραση Μ σε αλας μεταλλου Μ’ (M δραστικότερο M’)
Η ηλεκτροχημική σειρά των μετάλλων είναι:
| Li K Ba Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H2 Bi |
|---|
Α2. Επίδραση δραστικου μεταλλου (Κ,Να , Ca , Na ) σε νερο
Β. Αμέταλλα :
Σειρά δραστικότητας των αμέταλλων, με τα πιο δραστικά να βρίσκονται αριστερά :
Διπλή αντικατάσταση
Οι αντιδράσεις διπλής αντικατάστασης είναι αντιδράσεις στις οποίες ο αριθμός οξείδωσης των στοιχείων παραμένει σταθερός. Στις αντιδράσεις αυτές γίνεται ανταλλαγή των ιόντων με βάση το παρακάτω σχήμα :
1. άλας1 + οξύ1 → άλας2 + οξύ2
2. άλας1 + βάση1 → άλας2 + βάση2
3. άλας1 + άλας4→ άλας3 + άλας2
Β' Λυκείου
Οξείδωση αλκοολών
Εισαγωγικές γνώσεις
Οι πρωτοταγείς και οι δευτεροταγείς αλκοόλες οξειδώνονται με ισχυρά οξειδωτικά μέσα.:
Το όξινο διάλυμα
Το όξινο διάλυμα
Οι αντιδράσεις που λαμβάνουν χώρα κατά περίπτωση είναι
Πρωτοταγείς αλκοόλες:
Δευτεροταγείς αλκοόλες:
Τριτοταγείς αλκοόλες:
Δεν οξειδώνονται
Ερμηνεία Φαινομένου
Σε πρώτο στάδιο έχουμε απομάκρυνση υδρογόνων από τον άνθρακα του υδροξυλίου και από το υδροξύλιο με αποτέλεσμα τα μονήρη ηλεκτρόνια που απομένουν να δημιουργήσουν τον δεύτερο δεσμό μεταξύ άνθρακα και οξυγόνου.
Eίναι προφανές ότι η έλλειψη υδρογόνου στον άνθρακα του υδροξυλίου των τριτοταγών αλκοολών είναι το αίτιο ώστε αυτές να μην οξειδώνονται.
Οι αλδεΰδες οι οποίες είναι προϊόντα μερικής οξείδωσης των αλκοολών, οξειδώνονται περαιτέρω ακόμα και με ήπια οξειδωτικά μέσα όπως το αντιδραστήριο Tollens και το αντιδραστήριο Fehling, προς καρβονικά οξέα (
Είναι προφανές ότι η έλλειψη υδρογόνου στον άνθρακα της καρβονυλομάδας στις κετόνες είναι το αίτιο ώστε αυτές να μην οξειδώνονται.
Γ' Λυκείου
Δείκτες – Ογκομέτρηση
Ισοδύναμα σημεία και PH
Οι δείκτες αυτοί είναι συνήθως ασθενή οργανικά οξέα ή βάσεις των οποίων τα μόρια έχουν
διαφορετικό χρώμα από τα αντίστοιχα ιόντα στα οποία έχουν ιοντιστεί.
Έστω αντίδραση ιοντισμού ενός δείκτη
Τα μόρια του δείκτη στην όξινη μορφή του (
Έχει διαπιστωθεί πως όταν η συγκέντρωση του ΗΑ είναι δεκαπλάσια της συγκέντρωσης του
- Με σταδιακή προσθήκη οξέος, η παραπάνω ισορροπία μετατοπίζεται προς τ’ αριστερά, οπότε το
χρώμα του της όξινης μορφής του δείκτη (
- Με προσθήκη βάσης η ισορροπία μετατοπίζεται δεξιά, οπότε η βασική μορφή του δείκτη
- Το χρώμα δηλαδή που παίρνει τελικά το διάλυμα εξαρτάται από το pH και τη σταθερά ιοντισμού
του δείκτη
Η μέτρηση της οξύτητας του λαδιού
Η αρχή λειτουργίας της μεθόδου μέτρησης της οξύτητας του λαδιού στηρίζεται στην τιτλοδότηση με αλκάλι συγκεκριμένης συγκεντρώσεως, μέχρι ολικής εξουδετερώσεως της οξύτητας του
ελαιολάδου. Ο απαραίτητος εξοπλισμός είναι ογκομετρικός σωλήνας, κωνική φιάλη, προχοϊδα( ή μια σύριγγα), και αντιδραστήρια (διάλυμα αλκοόλης, δείκτης (φαινολοφθαλεΐνης), διάλυμα υδροξειδίου του Νατρίου NaOH)
Η διαδικασία είναι η εξής:
Προσθέτουμε σε ογκομετρικό κύλινδρο λάδι μέχρι να καλύψει τη γραμμή των 11 ml. Στη συνέχεια το ρίχνουμε μέσα στην κωνική φιάλη.
Ξεπλένουμε τον ογκομετρικό κύλινδρο με καθαρό οινόπνευμα 2 φορές, δηλαδή τον γεμίζουμε μέχρι την χαραγή των 11 ml, ανακινώντας καλά τον ογκομετρικό κύλινδρο και ρίχνουμε το περιεχόμενο στην κωνική φιάλη.
Προσθέτουμε 7 σταγόνες δείκτη φαινολοφθαλεΐνης. Ανακινούμε καλά την κωνική φιάλη.
Τιτλοδοτούμε με την προχοϊδα ή τη σύριγγα (με συνεχή ανακίνηση) με το διάλυμα του NaOH. Η ανάδευση πρέπει να είναι καλή και η αλλαγή του χρώματος σε όλη τη μάζα του υγρού.
Ρίχνουμε ακόμη μερικές σταγόνες διάλυμα NaOH σιγά – σιγά μέσα στην κωνική φιάλη.
Η μέτρηση ολοκληρώνεται όταν αλλάξει το χρώμα του δείκτη από ανοικτό πράσινο σε ανοικτό κόκκινο. Η αλλαγή χρώματος πρέπει να παραμένει μετά από καλή ανάδευση.
Για τον υπολογισμό της οξύτητας μετράμε τα ml του διαλύματος NaOH που καταναλώθηκαν από την πτώση της στάθμης στην προχοϊδα. Καταγράφουμε την ένδειξη.
Για κάθε 1 ml διαλύματος NaOH που καταναλώθηκε αντιστοιχεί 1 βαθμοί οξύτητας. Άρα για κάθε 0,1 ml (δέκατο του ml) αντιστοιχούν 0,1 βαθμοί οξύτητας . Έτσι, π.χ. αν καταγράφηκαν 0,5 ml τότε η οξύτητα είναι 0,5 βαθμοί, ενώ αν καταναλώθηκαν 1,7 ml τότε η οξύτητα είναι 1,7 βαθμοί.
Tαχύτητα αντίδρασης
Παράγοντες που επηρεάζουν την ταχύτητα αντίδρασης.
Η ταχύτητα μιας αντίδρασης εξαρτάται από τον αριθμό των αποτελεσματικών συγκρούσεων μεταξύ των αντιδρώντων μορίων. Είναι προφανές ότι οι παράγοντες που επηρεάζουν τον αριθμό αυτών των συγκρούσεων, επηρεάζουν και την ταχύτητα της αντίδρασης. Οι παράγοντες αυτοί είναι οι εξής:
- η συγκέντρωση των αντιδρώντων
- η πίεση, με την προϋπόθεση ότι ένα τουλάχιστον απ΄ τα αντιδρώντα σώματα είναι αέριο
- η επιφάνεια επαφής των στερεών
- η θερμοκρασία
- οι ακτινοβολίες
- οι καταλύτες.
Επίδραση της συγκέντρωσης στην ταχύτητα της αντίδρασης
Πείραμα 1
Η επίδραση της συγκέντρωσης στην ταχύτητα της αντίδρασης μπορεί να παρατηρηθεί με το πείραμα της αντίδρασης υδροχλωρικού οξέος (
Μεταβάλλοντας την συγκέντωση του
Πείραμα 2
Στο πείραμα αυτό θα μελετήσουμε την μετατόπιση της θέσης ισορροπίας στην αμφίδρομη αντίδραση:
(κίτρινος χλωριούχος-σίδηρος άχρωμο θειοκυανικό αμμώνιο κόκκινος θειοκυανικός-σιδηρος)
Με προσθήκη ή αφαίρεση μιας ποσότητας αντιδρώντων ή προϊόντων η ισορροπία μετατοπίζεται προς ορισμένη κατεύθυνση και το χρώμα μεταβάλλεται
Αρχή Le Chatelier
Παράγοντες που επηρεάζουν τη θέση χημικής ισορροπίας - Αρχή Le Chatelier
Όπως ήδη αναφέραμε, μια αντίδραση εξελίσσεται με τέτοιο τρόπο, ώστε να φτάσει τελικά σε κατάσταση χημικής ισορροπίας. Η κατάσταση αυτή τείνει να διατηρηθεί, εφόσον το χημικό σύστημα δεν διαταράσσεται. Αν διαταράξουμε το σύστημα ισορροπίας, μεταβάλλοντας π.χ. τη θερμοκρασία, τότε η θέση χημικής ισορροπίας θα μετατοπιστεί προς εκείνη την κατεύθυνση που τείνει να αναιρέσει τη μεταβολή που επιφέραμε. Για παράδειγμα, αν επιβάλλουμε μείωση θερμοκρασίας στο παρακάτω σύστημα ισορροπίας:
τότε η αντίδραση θα εξελίσσεται ταχύτερα προς τα δεξιά απ’ ότι προς τα αριστερά επηδεί η αντιδραση προς τα δεξιά ειναι εξωθερμη ωστε να αυξηθεί η θερμοκρασία και με αποτέλεσμα να αυξηθεί η ποσότητα του
Σε αυτή την περίπτωση λέμε ότι η θέση ισορροπίας μετατοπίστηκε προς τα δεξιά.
Παράγοντες που επηρεάζουν τη θέση χημικής ισορροπίας
Η θέση ισορροπίας επηρεάζεται από τους εξής παράγοντες χημικής ισορροπίας:
- τη συγκέντρωση των αντιδρώντων ή προϊόντων,
- την πίεση,
- τη θερμοκρασία.
Επίδραση της θερμοκρασίας στη χημική ισορροπία
Πείραμα 1
Θα μελετήσουμε τη μετατόπιση της θέσης χημικής ισορροπίας, όταν μεταβάλλουμε τη θερμοκρασία στην παρακάτω χημική αντίδραση:
(μπλε) (πράσινο)
Με αύξηση της θερμοκρασίας η θέση της ισορροπίας μετατοπίζεται προς τα δεξιά και το διάλυμα από μπλε που ήταν αρχικά αποκτά πράσινο χρώμα. Όταν μειώσουμε τη θερμοκρασία συμβαίνει το αντίθετο.
Πείραμα 2
Θα μελετήσουμε τη μετατόπιση της θέσης χημικής ισορροπίας, όταν μεταβάλλουμε τη θερμοκρασία στην παρακάτω χημική αντίδραση:
Με αύξηση της θερμοκρασίας η θέση της ισορροπίας μετατοπίζεται προς τα δεξιά και το διάλυμα από ροδόχρωμο που ήταν αρχικά αποκτά μπλε χρώμα. Όταν μειώσουμε τη θερμοκρασία συμβαίνει το αντίθετο.
https://pubchem.ncbi.nlm.nih.gov/compound/Cobalt-chloride-_CoCl2#section=Physical-Description
##